中国抗癌药出口美国?专家:这不是金榜题名,是忍辱负重
核心提要:
1. 5月31日,齐鲁制药生产的化疗药物顺铂注射液开始向美国发货。2个月前,美国食品药品监督管理局(FDA) 紧急联系齐鲁制药,称顺铂缺货,原因是生产顺铂的印度公司掉了链子,无法提供药品。顺铂是重要的癌症化疗药物,很多联合治疗方案里都要使用,顺铂短缺对美国癌症患者而言是致命危机。
2. 近年来,中国在创新药研发上蓬勃发展,目前有很多临床试验都在国外开展。目前已有6种中国的创新药在美国获批上市,包括泽布替尼、西达基奥仑赛、马来酸左旋氨氯地平(玄宁)、艾巴利珠单抗、埃特司韦单抗和本维莫德,分别用于治疗淋巴瘤、骨髓瘤、高血压、艾滋病、新冠和银屑病。
3. 除已经上市的创新药,中国还有几款创新药在等待FDA审批,这些创新药的海外上市时间之前因为疫情原因有所耽误。美国有3/4的处方药来自印度的仿制药,印度这次掉链子确实给中国公司带来了机会,但中国的制药业要真正做大做强,发展创新药才是王道。
01
2个月走完美国“上市”流程,FDA特批齐鲁的顺铂化疗药是什么操作?
5月31日,齐鲁制药宣布了一个小小的消息:齐鲁生产的化疗药物顺铂注射液开始向美国发货。
请注意一下,齐鲁制药并没有提“FDA批准”。没有批准,上来就发货,而且发货很急,直接带着中文的标签就出口到美国了。
这是什么操作?
复盘一下此事,其实是在今年3月,齐鲁制药收到FDA顺铂缺货的紧急邮件。缺货的原因,是生产顺铂的印度公司掉链子了,无法提供药品。
顺铂是很重要的癌症化疗药物,虽然现在有靶向药、免疫治疗等新型的药物出现,但是仍然不能完全取代化疗,很多联合治疗方案里都要使用顺铂。据美国国家癌症研究所(NCI)统计,约10%至20%癌症患者服用“顺铂”治疗肿瘤,而且自1975年以来,“顺铂”类抗肿瘤药物可降低睾丸癌死亡率三分之二,并且可用于治疗肺癌、膀胱癌、子宫颈癌和卵巢癌等。
但出乎意料的是,一直供应美国医院顺铂的印度制药厂Intas Pharmaceuticals因质量问题,停止生产“顺铂”和一种名为“卡铂”的类抗肿瘤药物。这家印度药厂供应的“顺铂”占美国国内半数以上供应,“卡铂”则占20%的市场。这些抗癌药物短缺,已成为危害癌症患者性命的危机。许多短缺的药品并没有有效药物可以替代。
癌症的治疗很急,稍有耽误,患者便有生命危险,所以尽管喊着要与中国脱钩,遇到人命关天的问题,美国自然不会忘记中国。
当然,FDA不太可能只是独家询问齐鲁,但是齐鲁肯定是抓住了这个机会,用了两个多月时间走完相关程序,将产品出口到了美国。
有人看到了美国出售药品上的中文,仿佛就看到了美国的衰落。我觉得这是过分解读。
美国缺货,并不是说没有生产顺铂的技术。因为这是一个老药,是一个专利过期的仿制药,没有太多的利润空间,美国的药企不愿意生产,把机会留给了印度的仿制药厂。
印度药厂掉链子了,才有了中国的机会。怎么看,都不应该是“金榜题名”的喜庆,而是“忍辱负重”的艰辛。
中国不可能只等着这种美国公司不愿做,印度公司掉链子的机会。中国要做制药强国,必须要用产品显示出做创新药的实力。
那么,美国有没有正式批准的中国创新药?有!
近年来,中国的创新药研发也确实在蓬勃发展,在走向世界,目前有很多临床试验都在国外开展,但是由于媒体存在误导性的用词,“批准临床试验”可能就被替换成“批准”,让吃瓜群众以为很多药物都在美国获得了正式批准。
中国有多少创新药在美国获得了批准?我们来梳理一下。
02
美国上市的中国创新药大盘点
1. 泽布替尼:用于复发难治性套细胞淋巴瘤的治疗
2019年11月14日,美国FDA批准百济神州研发的泽布替尼,用于复发难治性套细胞淋巴瘤的治疗。对于中国的现代制药史来说,这一天意义非凡。
泽布替尼是历史上第一个完全由中国企业自主研发,得到FDA获批的抗癌新药。此后,泽布替尼也在世界多国获得多适应症的批准:
·2020年6月,泽布替尼在中国获批,适应症包括MCL和CLL;
·2020年年底,泽布替尼快步小跑进入了新版医保目录,以更优惠的价格,服务于中国的患者;
·2021年9月,FDA批准泽布替尼用于WM、复发性或难治性边缘区淋巴瘤(R/R MZL)适应症;
·2021年2-3月,泽布替尼先后在阿联酋、加拿大获批;
·2023年5月,FDA批准泽布替尼用于CLL治疗。
2022年,泽布替尼全球销售额总计38.29亿元(约5.65亿美元),其中来自美国市场的收入为26.44亿元,上年同期为7.46亿元,同比增长超过200%。
2. 西达基奥仑赛: 用于治疗复发或难治性多发性骨髓瘤
2022年2月28日,金斯瑞旗下的传奇生物研发的BCMA CAR-T药品西达基奥仑赛获得FDA的批准上市,用于治疗复发或难治性多发性骨髓瘤。这是中国首个获FDA批准的细胞治疗产品。作为第2款BCMA CAR-T,西达基奥仑赛在美国的定价为46.5万美元。
在关键性Ib/II期CARTITUDE-1临床研究中,共招募97例受试者,其中99%接受末线治疗无效,且 88%已接受过至少3线治疗。研究结果显示,西达基奥仑赛获得的客观缓解率(ORR)为97%,包括67%的sCR(严格的完全缓解),26% 的VGPR(非常好的部分缓解)和4%的PR。在不良反应方面, 细胞因子综合征(CRS)(3级及以上)发生率为5%, 神经毒性(3级及以上)发生率为10%。
在美国成功上市之后,西达基奥仑赛也在欧盟和日本上市成功。根据金斯瑞发布的公告,截至2022年12月31日,西达基奥仑赛上市首年度累计销售额共计1.34亿美元,约合人民币9.1亿元。
3. 马来酸左旋氨氯地平片(玄宁) :中国首个在美上市的高血压药物
氨氯地平不是新药,是一个有很多年历史的抗高血压老药,作用机制为钙通道拮抗剂,通过阻断血管平滑肌细胞上的钙离子通道,可以松弛血管平滑肌,从而达到降压的作用。
但是马来酸左旋氨氯地平却是一个新药!在传统的氨氯地平中,有两个空间构象不同的分子,互为镜像,一个左旋,一个右旋。真正有效果的, 是左旋氨氯地平。
石药成功地将氨氯地平拆分,只保留了有活性的左旋结构,不但可以将服药剂量减少一半,也可减少不良反应发生率,提高安全性和耐受性。在2003年,马来酸左旋氨氯地平片(玄宁)已在中国获批上市,用于高血压治疗。2019年12月,美国FDA批准马来酸左旋氨氯地平片(Conjupri)的上市申请。FDA的批准,是基于一项名为LEADER的临床研究,证实马来酸左旋氨氯地平血压控制率达到94.24%,对高血压患者心脑血管复合终点事件的预防能力良好。
2018年, 玄宁的销售额为9.7亿元,2019年销售额近15亿元。根据石药集团年报,2020年玄宁销售增长达到36.8%。
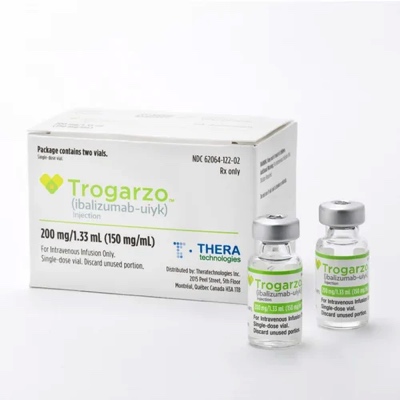
4. 艾巴利珠单抗(Ibalizumab) :艾滋病治疗新药
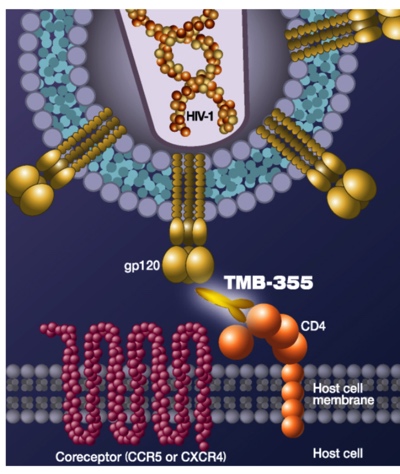
Ibalizumab是CD4单克隆抗体,可与细胞表面CD4结合,阻止HIV病毒感染进入淋巴细胞。该抗体最早的名字为TMB-365,由美国洛克菲勒大学Arron Diamond AIDS Research Center (ADARC)研发,一开始转让到美国的大药企,但后来中裕新药从美国公司买下了独家授权,在全球开发。中裕新药委托药明生物进行抗体药物生产,继而进行了临床试验。
图片来自TaiMed Biologics 网站
入组了40名患者的临床试验结果显示,对于这些已经使用过三种以上抗艾滋病药物的患者,55%的人经过Ibalizumab治疗之后,HIV病毒滴度减少了90%。2018年3月,美国批准艾巴利珠单抗上市,用于治疗对多种疗法耐药的成人HIV感染者,商品名为Trogarzo。
本来感觉无药可救的HIV感染者,因Ibalizumab的成功上市,又获得了生的希望。Ibalizumab由中裕新药的合作伙伴Theratechnologies负责商业销售,根据年报,2022年销售额为2960万美元,同比增长为10.4%。
5. 埃特司韦单抗(etesevimab):FDA批准的中国首个抗新冠病毒的双抗体疗法
2021年2月18日,美国FDA批准了抗新冠病毒的双抗体疗法(etesevimab 1,400 mg及bamlanivimab 700 mg),作为紧急使用(EUA),用于12岁及以上轻中度COVID-19患者的早期治疗,减少重度及住院风险。这其中的etesevimab,即埃特司韦单抗,又称JS016/LY-CoV016,来自中国的君实生物,与中国科学院微生物研究所共同开发,由礼来制药引进美国。
埃特司韦单抗是一种重组全人源单克隆中和抗体,以高亲和力特异性结合SARS-CoV-2 表面刺突蛋白受体结合域,并能有效阻断病毒与宿主细胞表面受体ACE2 的结合。
对于抗体药物,从确认序列到临床试验申报,一般需要18个月,但是埃特司韦单抗只用了4个月!这是一个奇迹,但也是因为疫情因素。3期临床试验数据显示,埃特司韦及 bamlanivimab 双抗体疗法改善了轻中度COVID-19 患者的症状,并且使 COVID-19 住院及死亡风险降低 70%。
根据礼来制药与君实生物的协议,礼来获得埃特司韦单抗的海外商业权益。礼来向君实生物支付1000万美元首付款,并在实现规定的里程碑事件后,最高需要向君实生物支付2.45亿美元的里程碑款,外加该产品销售净额两位数百分比的销售分成。
在美国之后,礼来的双抗体疗法在全球15个国家和地区获得紧急使用授权,仅仅美国政府就与礼来签下了18.3亿美元的合同,用于采购双抗或埃特司韦单抗,其中埃特司韦单抗的销售额预计超过10亿美元。但是因为新冠病毒发生突变,所有紧急批准的中和抗体都先后失去对病毒的中和能力,埃特司韦也就被停用了。
但无论如何,埃特司韦单抗在中国创新药的历史上也实现一个里程碑!
6. 本维莫德:用于成人斑块型银屑病的局部治疗
2022年5月24日,Dermavant Sciences宣布FDA已批准VTAMA(本维莫德,1%)乳膏上市,用于成人斑块型银屑病的局部治疗。本维莫德由国内企业天济医药研发、是具有自主知识产权的“first-in-class”首创新药。
2012年,天济医药将本维莫德境外开发权授予GSK,合同首付款约2亿美元; 2018年7月,GSK又以3.3亿美元的价格将本维莫德在中国境外的开发权出售给Dermavant公司。
早在2019年5月,本维莫德以“1类新药”在国内获批上市,用于适合局部治疗的成人轻至中度稳定性寻常型银屑病。这也是目前首款我国先批准上市之后才获美国FDA批准的创新药。
03
顺铂值得祝贺,但发展创新药才是王道
除了以上的几款创新药,中国还有几款创新药在等待美国FDA审批,其中包括君实生物和百济神州的PD-1单抗。之前由于疫情的原因,FDA无法派人到中国实施现场核查,耽误了这些创新药的海外上市时间。
这份美国批准上市的中国创新药名单并不长,但是会越来越长。
齐鲁出口美国的顺铂,无论怎么看,都是一件值得高兴的事!机会都是留给有准备的人,只有踏踏实实做事,才会有捡漏的机会。
但顺铂出口美国并不值得全民狂欢。正如黄连素在美国也可以合法销售,并不能说明中药就征服了美国。
顺铂卡住了美国患者的脖子,但是对于美国来说,这绝对不是一个卡脖子的技术。
如果要比一比在美国销售的仿制药,那中国被印度甩了N条街。有数据表明,在美国的处方药中,有四分之三都是来自印度的非专利药(仿制药)。
印度的仿制药掉链子,确实是中国公司的机会,但是中国的制药业要真正做大做强,发展创新药才是王道。
期待更多的关注投射到创新药物的研发与政策支持!
期待更多的创新药出海!

微信扫一扫,进入读者交流群
本文内容仅为作者个人观点,不代表网站立场。
请支持独立网站红色文化网,转载请注明文章链接----- https://www.hswh.org.cn/wzzx/llyd/jj/2023-06-09/82189.html-红色文化网